 |
|||
|
|||
| نام ها | |||
|---|---|---|---|
| نام IUPAC
دی اکسید کربن
|
|||
نامهای دیگر
|
|||
| شناسه ها | |||
|
شماره CAS
|
|
||
|
مدل سه بعدی ( JSmol )
|
|
||
| 3DMeet |
|
||
|
مرجع بیلشتاین
|
1900390 | ||
| ChEBI |
|
||
| محفظه – اتاق |
|
||
| ChemSpider |
|
||
| کارت اطلاعات ECHA | 100.004.271 |
||
| شماره EC |
|
||
| شماره E | E290 (مواد نگهدارنده) | ||
|
مرجع Gmelin
|
989 | ||
| KEGG |
|
||
| مش | کربن + دی اکسید | ||
|
PubChem CID
|
|
||
| شماره RTECS |
|
||
| مقداری |
|
||
| یک عدد | 1013 (گاز)، 1845 (جامد) | ||
|
داشبورد CompTox ( EPA )
|
|
||
|
InChI
|
|||
|
لبخند می زند
|
|||
| خواص | |||
|
فرمول شیمیایی
|
CO2 _ _ | ||
| جرم مولی | 44.009 g·mol -1 | ||
| ظاهر | گاز بی رنگ | ||
| بو |
|
||
| تراکم |
|
||
| نقطه بحرانی ( T , P ) | 304.128 (15) K [2] (30.978 (15) درجه سانتیگراد)، 7.3773 (30) MPa [2] (72.808 (30) اتمسفر) | ||
|
شرایط تصعید
|
194.6855 (30) K (-78.4645 (30) درجه سانتی گراد) در 1 atm (0.101325 مگاپاسکال) | ||
|
حلالیت در آب
|
1.45 گرم در لیتر در 25 درجه سانتی گراد (77 درجه فارنهایت)، 100 کیلو پاسکال (0.99 اتمسفر) | ||
| فشار بخار | 5.7292 (30) مگاپاسکال، 56.54 (30) اتمسفر (20 درجه سانتی گراد (293.15 K)) | ||
| اسیدیته ( p Ka ) | 6.35، 10.33 | ||
|
حساسیت مغناطیسی (χ)
|
-20.5 · 10 -6 سانتی متر 3 / مول | ||
| رسانایی گرمایی | 0.01662 W·m -1 ·K -1 (300 K (27 °C؛ 80 °F)) [3] | ||
|
ضریب شکست ( n D )
|
1.00045 | ||
| ویسکوزیته |
|
||
|
لحظه دوقطبی
|
0 D | ||
| ساختار | |||
|
ساختار کریستالی
|
سه ضلعی | ||
|
شکل مولکولی
|
خطی | ||
| ترموشیمی | |||
|
ظرفیت حرارتی ( C )
|
37.135 J/(K·mol) | ||
|
آنتروپی مولر STd ( S ⦵ 298 )
|
214 J·mol -1 ·K -1 | ||
|
آنتالپی تشکیل STD (Δ f H ⦵ 298 )
|
-393.5 کیلوژول · مول -1 | ||
| فارماکولوژی | |||
|
کد ATC
|
V03AN02 ( WHO ) | ||
| خطرات | |||
| NFPA 704 (الماس آتشین) |
[7] [8]

2
0
0
بر
|
||
| دوز یا غلظت کشنده (LD، LC): | |||
|
LC Lo ( کمترین منتشر شده )
|
90000 ppm (162000 mg/m3 ) (انسان، 5 دقیقه) [6] | ||
| NIOSH (محدودیت های قرار گرفتن در معرض سلامت ایالات متحده): | |||
|
FUR (مجاز)
|
TWA 5000 ppm (9000 mg/m3 ) [ 5] | ||
|
REL (توصیه می شود)
|
TWA 5000 ppm (9000 mg/m3 ) ، ST 30000 ppm (54000 mg/m3 ) [ 5] | ||
|
IDLH (خطر فوری)
|
40000 ppm (72000 mg/m3 ) [ 5] | ||
| برگه اطلاعات ایمنی (SDS) | سیگما آلدریچ | ||
| ترکیبات مرتبط | |||
|
آنیون های دیگر
|
|
||
|
کاتیون های دیگر
|
|
||
|
اکسیدهای کربن مرتبط
|
رجوع به Oxocarbon شود | ||
|
ترکیبات مرتبط
|
|
||
| صفحه داده های تکمیلی | |||
| دی اکسید کربن (صفحه داده) | |||
|
به جز مواردی که غیر از این ذکر شده است، داده ها برای مواد در حالت استاندارد آنها (در دمای 25 درجه سانتیگراد [77 درجه فارنهایت]، 100 کیلو پاسکال) ارائه می شود .
ارجاعات صندوق اطلاعات
|
|||
دی اکسید کربن یک ترکیب شیمیایی با فرمول شیمیایی CO 2 است . از مولکول هایی تشکیل شده است که هر یک دارای یک اتم کربن هستند که به دو اتم اکسیژن پیوند کووالانسی دارند. در حالت گاز در دمای اتاق یافت می شود و به عنوان منبع کربن موجود در چرخه کربن ، CO 2 اتمسفر منبع اصلی کربن برای حیات روی زمین است. در هوا، دی اکسید کربن برای نور مرئی شفاف است اما تابش مادون قرمز را جذب می کند و به عنوان گاز گلخانه ای عمل می کند . دی اکسید کربن در آب محلول است و در آب های زیرزمینی ، دریاچه ها ، کلاهک های یخی و آب دریا یافت می شود . هنگامی که دی اکسید کربن در آب حل می شود، کربنات و عمدتاً بی کربنات ( HCO-3) که با افزایش سطح CO 2 اتمسفر باعث اسیدی شدن اقیانوس می شود . [9]
این گاز کمیاب در جو زمین با 421 قسمت در میلیون (ppm) [یادداشت 1] ، یا حدود 0.04٪ (تا می 2022) است که از سطوح قبل از صنعتی 280 ppm یا حدود 0.025٪ افزایش یافته است. [11] [12] سوزاندن سوخت های فسیلی علت اصلی این افزایش غلظت CO 2 و همچنین علت اصلی تغییرات آب و هوایی است . [13]
غلظت آن در جو پیش از صنعت زمین از اواخر دوره پرکامبرین توسط موجودات و پدیده های زمین شناسی تنظیم می شد. گیاهان ، جلبک ها و سیانوباکتری ها از انرژی نور خورشید برای سنتز کربوهیدرات ها از دی اکسید کربن و آب در فرآیندی به نام فتوسنتز استفاده می کنند که باعث تولید اکسیژن به عنوان یک محصول زائد می شود. [14] به نوبه خود، اکسیژن مصرف میشود و CO 2 بهعنوان ضایعات توسط همه موجودات هوازی آزاد میشود که آنها ترکیبات آلی را برای تولید انرژی از طریق تنفس متابولیزه میکنند . [15] CO 2 از مواد آلی در هنگام پوسیدگی یا احتراق، مانند آتش سوزی جنگل، آزاد می شود. از آنجایی که گیاهان برای فتوسنتز به CO 2 نیاز دارند و انسان و حیوانات برای غذا به گیاهان وابسته هستند، CO 2 برای بقای حیات روی زمین ضروری است.
دی اکسید کربن 53 درصد چگالی تر از هوای خشک است، اما عمر طولانی دارد و به طور کامل در جو مخلوط می شود. حدود نیمی از انتشار CO2 اضافی در جو توسط غرقهای کربن خشکی و اقیانوسی جذب میشود . [16] این غرقها میتوانند اشباع شده و فرار باشند، زیرا پوسیدگی و آتشسوزیهای جنگلی منجر به آزاد شدن CO 2 به جو میشود. [17] CO 2 در نهایت در سنگ ها و ذخایر آلی مانند زغال سنگ ، نفت و گاز طبیعی جدا می شود (برای طولانی مدت ذخیره می شود) . CO 2 جدا شده از طریق سوزاندن سوخت های فسیلی یا به طور طبیعی توسط آتشفشان ها ، چشمه های آب گرم ، آبفشان ها و هنگامی که سنگ های کربناته در آب حل می شوند یا با اسیدها واکنش می دهند، در جو آزاد می شود.
CO 2 یک ماده صنعتی همه کاره است که به عنوان مثال به عنوان یک گاز بی اثر در جوشکاری و کپسول آتش نشانی ، به عنوان گاز تحت فشار در تفنگ های هوا و بازیافت روغن، و به عنوان یک حلال سیال فوق بحرانی در کافئین زدایی قهوه و خشک کردن فوق بحرانی استفاده می شود. این محصول فرعی تخمیر قندها در نان ، آبجو و شراب سازی است و برای جوشاندن به نوشیدنی های گازدار مانند سلتزر و آبجو اضافه می شود. بوی تند و اسیدی دارد و طعم آب سودا را در دهان ایجاد می کند، اما در غلظت های معمولی بی بو است.
خواص شیمیایی و فیزیکی
ساختار، پیوند و ارتعاشات مولکولی
تقارن یک مولکول دی اکسید کربن در هندسه تعادل آن خطی و مرکز متقارن است . طول پیوند کربن -اکسیژن در دی اکسید کربن 116.3 pm است ، که به طور قابل توجهی کوتاهتر از طول تقریباً 140 pm یک پیوند معمولی C-O و کوتاهتر از سایر گروه های عاملی با پیوند C-O مانند کربونیل ها است . [19] از آنجایی که مولکول متقارن است، گشتاور دوقطبی الکتریکی ندارد .

به عنوان یک مولکول سه اتمی خطی، CO 2 دارای چهار حالت ارتعاشی همانطور که در نمودار نشان داده شده است. در حالت کشش متقارن و ضد متقارن، اتم ها در امتداد محور مولکول حرکت می کنند. دو حالت خمشی وجود دارد که انحطاط دارند ، به این معنی که به دلیل تقارن مولکول، فرکانس و انرژی یکسانی دارند. هنگامی که یک مولکول یک سطح را لمس می کند یا مولکول دیگری را لمس می کند، دو حالت خمشی می توانند از نظر فرکانس متفاوت باشند زیرا برهمکنش برای دو حالت متفاوت است. برخی از حالتهای ارتعاشی در طیف مادون قرمز (IR) مشاهده میشوند : حالت کشش ضد متقارن در شماره موج 2349 سانتیمتر -1 (طول موج 4.25 میکرومتر) و جفت منحط حالتهای خمشی در 667 سانتیمتر -1 (طول موج 15 میکرومتر). حالت کشش متقارن یک دوقطبی الکتریکی ایجاد نمی کند، بنابراین در طیف سنجی IR مشاهده نمی شود، اما با طیف سنجی رامان در 1388 سانتی متر -1 (طول موج 7.2 میکرومتر) تشخیص داده می شود.
در فاز گاز، مولکول های دی اکسید کربن تحت حرکات ارتعاشی قابل توجهی قرار می گیرند و ساختار ثابتی را حفظ نمی کنند. با این حال، در آزمایش تصویربرداری انفجار کولن ، می توان یک تصویر آنی از ساختار مولکولی استنباط کرد. چنین آزمایشی [21] برای دی اکسید کربن انجام شده است. نتیجه این آزمایش و نتیجه گیری محاسبات نظری [22] بر اساس سطح انرژی پتانسیل اولیه مولکول، این است که هیچ یک از مولکول های فاز گاز هرگز دقیقاً خطی نیستند. این نتیجه غیر شهودی به طور پیش پا افتاده به دلیل این واقعیت است که عنصر حجم حرکت هسته ای برای هندسه های خطی ناپدید می شود. [22] این برای همه مولکول ها (به جز دیاتومیک ها!) صادق است.
در محلول آبی
دی اکسید کربن در آب محلول است که در آن به طور برگشت پذیر H 2 CO 3 (اسید کربنیک) تشکیل می دهد که اسید ضعیفی است زیرا یونیزاسیون آن در آب ناقص است.
- CO 2 + H 2 O ⇌ H 2 CO 3
ثابت تعادل هیدراتاسیون اسید کربنیک در 25 درجه سانتیگراد است:
- کساعت=[اچ2CO3][CO2(ق)]=1.70×10-3
از این رو، اکثر دی اکسید کربن به اسید کربنیک تبدیل نمی شود، اما به عنوان مولکول CO 2 باقی می ماند و بر pH تأثیر نمی گذارد.
غلظت نسبی CO 2 ، H 2 CO 3 ، و HCO شکل های deprotonated-3( بی کربنات ) و CO2-3( کربنات ) به pH بستگی دارد . همانطور که در نمودار Bjerrum نشان داده شده است، در آب خنثی یا کمی قلیایی (pH> 6.5)، فرم بی کربنات غالب است (> 50٪) و در pH آب دریا رایج ترین (> 95٪) است. در آب بسیار قلیایی (PH> 10.4)، فرم غالب (بیش از 50٪) کربنات است. اقیانوس ها، قلیایی ملایم با pH معمولی 8.2-8.5، حاوی حدود 120 میلی گرم بی کربنات در هر لیتر هستند.
اسید کربنیک از آنجایی که دیپروتیک است ، دارای دو ثابت تفکیک اسیدی است ، اولین مورد برای تفکیک به یون بی کربنات (که کربنات هیدروژن نیز نامیده می شود) ( HCO)-3):
- H 2 CO 3 ⇌ HCO-3+ H +
- Ka1 = 2.5 × 10-4 mol /L. p K a1 = 3.6 در 25 درجه سانتیگراد. [19]
این اولین ثابت تفکیک اسید واقعی است که به صورت تعریف شده است
- کآ1=[HCO3-][اچ+][اچ2CO3]
که در آن مخرج فقط شامل H 2 CO 3 متصل کووالانسی است و CO 2 هیدراته (aq) را شامل نمی شود . مقدار بسیار کوچکتر و اغلب نقل قولی نزدیک به 4.16 × 10-7 یک مقدار ظاهری است که با این فرض (نادرست) محاسبه می شود که تمام CO 2 محلول به صورت اسید کربنیک وجود دارد، به طوری که
- کآ1(آپپآrهnتی)=[HCO3-][اچ+][اچ2CO3]+[CO2(ق)]
از آنجایی که بیشتر CO 2 محلول به عنوان مولکول CO 2 باقی می ماند ، Ka1 (ظاهری) مخرج بسیار بزرگتر و مقدار بسیار کوچکتری نسبت به Ka1 واقعی دارد . [23]
یون بی کربنات یک گونه آمفوتریک است که بسته به pH محلول می تواند به عنوان اسید یا باز عمل کند. در pH بالا، به طور قابل توجهی به یون کربنات ( CO2-3):
- HCO-3⇌ CO2-3+ H +
- Ka2 = 4.69 × 10-11 mol /L. p K a2 = 10.329
در موجودات، تولید اسید کربنیک توسط آنزیمی به نام کربنیک انیدراز کاتالیز می شود .
واکنش های شیمیایی CO 2
CO 2 یک الکتروفیل قوی است که دارای واکنش الکتروفیلی است که با بنزآلدئید یا ترکیبات کربونیل غیر اشباع از α، β قوی قابل مقایسه است . با این حال، برخلاف الکتروفیلهای واکنشپذیری مشابه، واکنشهای هستهدوست با CO2 از نظر ترمودینامیکی کمتر مورد علاقه هستند و اغلب بهشدت برگشتپذیر هستند. [24] واکنش برگشت پذیر دی اکسید کربن با آمین ها برای ساخت کاربامات ها در اسکرابرهای CO 2 استفاده می شود و به عنوان نقطه شروع احتمالی برای جذب و ذخیره کربن توسط تصفیه گاز آمین پیشنهاد شده است . فقط نوکلئوفیلهای بسیار قوی، مانند کربنیونهای ارائهشده توسط معرفهای گریگنارد و ترکیبات ارگانولیتیوم با CO2 واکنش میدهند و کربوکسیلات میدهند :
- MR + CO 2 → RCO 2 M
- که در آن M = Li یا Mg Br و R = آلکیل یا آریل است .
در کمپلکس های دی اکسید کربن فلزی ، CO 2 به عنوان لیگاند عمل می کند که می تواند تبدیل CO 2 را به سایر مواد شیمیایی تسهیل کند. [25]
کاهش CO 2 به CO معمولاً یک واکنش دشوار و کند است:
- CO 2 + 2 e – + 2 H + → CO + H 2 O
فوتواتوتروف ها (یعنی گیاهان و سیانوباکتری ها ) از انرژی موجود در نور خورشید برای فتوسنتز قندهای ساده از CO2 جذب شده از هوا و آب استفاده می کنند:
- n CO 2 + n H 2 O → (CH 2 O ) n + n O 2
پتانسیل ردوکس برای این واکنش نزدیک به pH 7 در برابر الکترود هیدروژن استاندارد حدود 53/0- ولت است . آنزیم حاوی نیکل مونوکسید کربن دهیدروژناز این فرآیند را کاتالیز می کند. [26]
مشخصات فیزیکی

دی اکسید کربن بی رنگ است. در غلظت های پایین، گاز بی بو است. با این حال، در غلظت های به اندازه کافی بالا، بوی تند و اسیدی دارد. [1] در دما و فشار استاندارد ، چگالی دی اکسید کربن در حدود 1.98 کیلوگرم بر متر مکعب است ، در حدود 1.53 برابر چگالی هوا . [27]
دی اکسید کربن در فشارهای زیر 0.51795(10) MPa [2] (5.11177(99) atm ) حالت مایع ندارد . در فشار 1 اتمسفر (0.101325 مگاپاسکال)، گاز به طور مستقیم به یک جامد در دمای کمتر از 194.6855 (30) K [2] (-78.4645 (30) درجه سانتی گراد) رسوب می کند و جامد مستقیماً به گازی بالاتر از این دما تصعید می شود . در حالت جامد، دی اکسید کربن را معمولاً یخ خشک می نامند .

دی اکسید کربن مایع فقط در فشارهای بالاتر از 0.51795(10) MPa [2] (5.11177(99) atm) تشکیل می شود. نقطه سه گانه دی اکسید کربن 216.592 (3) K [2] (-56.558 (3) درجه سانتی گراد) در 0.51795 (10) MPa [2] (5.11177 (99) atm) است (نمودار فاز را ببینید). نقطه بحرانی 304.128 (15) K [2] (30.978 (15) درجه سانتیگراد) در 7.3773 (30) مگاپاسکال [2] (72.808 (30) atm) است. شکل دیگری از دی اکسید کربن جامد که در فشار بالا مشاهده می شود، جامد شیشه مانند آمورف است. [28] این شکل از شیشه، که کربنیا نامیده میشود، با فوقسرد کردن CO2 گرم شده در فشارهای شدید (40-48 GPa یا حدود 400000 اتمسفر) در سندان الماسی تولید میشود . این کشف این نظریه را تایید کرد که دی اکسید کربن می تواند در حالت شیشه ای مشابه سایر اعضای خانواده عنصری خود مانند دی اکسید سیلیکون (شیشه سیلیکا) و دی اکسید ژرمانیوم وجود داشته باشد . با این حال، برخلاف شیشههای سیلیس و آلمان، شیشه کربنیا در فشارهای معمولی پایدار نیست و با آزاد شدن فشار به گاز تبدیل میشود.
در دماها و فشارهای بالاتر از نقطه بحرانی، دی اکسید کربن مانند یک سیال فوق بحرانی به نام دی اکسید کربن فوق بحرانی رفتار می کند .
جدول خواص حرارتی و فیزیکی دی اکسید کربن مایع اشباع شده: [29] [30]
| دما (درجه سانتیگراد) | چگالی (kg/ m3 ) | گرمای ویژه (kJ/(kg⋅K)) | ویسکوزیته سینماتیکی (m2 / s) | هدایت حرارتی (W/(m⋅K)) | نفوذ حرارتی (m2 / s) | شماره پراندتل | مدول حجمی (K^-1) [ توضیحات لازم است ] |
جدول خواص حرارتی و فیزیکی دی اکسید کربن (CO 2 ) در فشار اتمسفر: [29] [30]
| دما (K) | چگالی (kg/ m3 ) | گرمای ویژه (kJ/(kg⋅°C)) | ویسکوزیته دینامیکی (kg/(m⋅s)) | ویسکوزیته سینماتیکی (m2 / s) | هدایت حرارتی (W/(m⋅°C)) | نفوذ حرارتی (m2 / s) | شماره پراندتل |
نقش بیولوژیکی
دی اکسید کربن محصول نهایی تنفس سلولی در ارگانیسم هایی است که با شکستن قندها، چربی ها و اسیدهای آمینه با اکسیژن به عنوان بخشی از متابولیسم خود، انرژی به دست می آورند . این شامل همه گیاهان، جلبک ها و حیوانات و قارچ ها و باکتری های هوازی می شود. در مهره داران ، دی اکسید کربن در خون از بافت های بدن به پوست (مثلاً دوزیستان ) یا آبشش ها (مثلاً ماهی )، از جایی که در آب حل می شود یا از جایی که بازدم می شود به ریه ها می رود. در طول فتوسنتز فعال، گیاهان می توانند دی اکسید کربن بیشتری را از جو جذب کنند تا اینکه در تنفس آزاد می کنند.
فتوسنتز و تثبیت کربن

تثبیت کربن یک فرآیند بیوشیمیایی است که در آن دی اکسید کربن اتمسفر توسط گیاهان، جلبک ها و (سیانوباکترها) به مولکول های آلی غنی از انرژی مانند گلوکز وارد می شود و بنابراین غذای خود را با فتوسنتز ایجاد می کند. فتوسنتز از دی اکسید کربن و آب برای تولید قندهایی استفاده می کند که از آنها می توان سایر ترکیبات آلی ساخت و اکسیژن به عنوان یک محصول جانبی تولید می شود.
ریبولوز-1،5-بیس فسفات کربوکسیلاز اکسیژناز ، که معمولاً به اختصار RuBisCO نامیده می شود، آنزیمی است که در اولین مرحله اصلی تثبیت کربن، تولید دو مولکول 3- فسفوگلیسرات از CO2 و ریبولوز بیس فسفات ، نقش دارد ، همانطور که در نمودار نشان داده شده است. ترک کرد.
RuBisCO تنها فراوان ترین پروتئین روی زمین است. [31]
فتوتروف ها از محصولات فتوسنتز خود به عنوان منابع غذایی داخلی و به عنوان ماده خام برای بیوسنتز مولکول های آلی پیچیده تر مانند پلی ساکاریدها ، اسیدهای نوکلئیک و پروتئین ها استفاده می کنند. این ها برای رشد خود و همچنین به عنوان پایه زنجیره های غذایی و شبکه هایی که سایر موجودات، از جمله حیواناتی مانند خودمان را تغذیه می کنند، استفاده می شود. برخی از فتوتروف های مهم، کوکولیتوفورها ، فلس های کربنات کلسیم سخت را سنتز می کنند . [32] یکی از گونههای مهم کوکولیتوفور در سطح جهانی، Emiliania huxleyi است که مقیاسهای کلسیتی آن اساس بسیاری از سنگهای رسوبی مانند سنگ آهک را تشکیل دادهاند ، جایی که کربن قبلاً اتمسفر میتواند برای مقیاسهای زمانی زمینشناسی ثابت بماند.

گیاهان می توانند در مقایسه با شرایط محیطی در غلظت های 1000 ppm CO 2 تا 50 درصد سریعتر رشد کنند ، اگرچه این فرض را بر هیچ تغییری در آب و هوا و هیچ محدودیتی در سایر مواد مغذی نمی گذارد. [33] افزایش سطح CO 2 باعث افزایش رشد می شود که در عملکرد قابل برداشت محصولات زراعی منعکس می شود، گندم، برنج و سویا همگی افزایش 12-14 درصدی در عملکرد را تحت افزایش CO 2 در آزمایشات FACE نشان دادند. [34] [35]
افزایش غلظت CO 2 اتمسفر منجر به رشد روزنه های کمتر در گیاهان می شود [36] که منجر به کاهش مصرف آب و افزایش راندمان مصرف آب می شود . [37] مطالعات با استفاده از FACE نشان دادهاند که غنیسازی CO 2 منجر به کاهش غلظت ریز مغذیها در گیاهان زراعی میشود. [38] این ممکن است اثرات ضربهای بر سایر بخشهای اکوسیستم داشته باشد زیرا گیاهخواران برای به دست آوردن همان مقدار پروتئین نیاز به خوردن غذای بیشتری دارند. [39]
غلظت متابولیتهای ثانویه مانند فنیل پروپانوئیدها و فلاونوئیدها نیز میتواند در گیاهانی که در معرض غلظتهای بالای CO2 قرار دارند، تغییر یابد . [40] [41]
گیاهان همچنین در طول تنفس CO 2 منتشر می کنند ، بنابراین اکثر گیاهان و جلبک ها که از فتوسنتز C3 استفاده می کنند ، فقط در طول روز جاذب خالص هستند. اگرچه یک جنگل در حال رشد هر سال تن های زیادی CO 2 را جذب می کند ، یک جنگل بالغ به همان میزانی که در فتوسنتز در گیاهان در حال رشد استفاده می شود، از تنفس و تجزیه نمونه های مرده (مانند شاخه های افتاده) CO2 تولید می کند. [42] برخلاف دیدگاه دیرینه مبنی بر اینکه آنها کربن خنثی هستند، جنگل های بالغ می توانند به انباشت کربن [43] ادامه دهند و مخازن کربن با ارزش باقی بمانند که به حفظ تعادل کربن جو زمین کمک می کند. علاوه بر این، فتوسنتز توسط فیتوپلانکتونها، و مهمتر از آن برای حیات روی زمین، CO2 محلول را در بالای اقیانوس مصرف میکند و در نتیجه جذب CO2 از جو را افزایش میدهد . [44]
سمیت

محتوای دی اکسید کربن در هوای تازه (به طور متوسط بین سطح دریا و 10 کیلو پاسکال، یعنی حدود 30 کیلومتر (19 مایل) ارتفاع) بسته به موقعیت مکانی بین 0.036٪ (360 ppm) و 0.041٪ (412 ppm) متغیر است. [46]
CO 2 یک گاز خفه کننده است و طبق استانداردهای سیستم جهانی هماهنگ طبقه بندی و برچسب گذاری مواد شیمیایی کمیسیون اقتصادی سازمان ملل متحد برای اروپا با استفاده از دستورالعمل های OECD برای آزمایش مواد شیمیایی به عنوان سمی یا مضر طبقه بندی نمی شود . در غلظت های تا 1% (10000 پی پی ام)، برخی افراد احساس خواب آلودگی می کنند و به ریه ها احساس گرفتگی می دهند. [45] غلظت 7٪ تا 10٪ (70000 تا 100000 ppm) ممکن است باعث خفگی شود، حتی در حضور اکسیژن کافی، که به صورت سرگیجه، سردرد، اختلال بینایی و شنوایی و بیهوشی در عرض چند دقیقه تا یک ساعت ظاهر می شود. [47] اثرات فیزیولوژیکی قرار گرفتن در معرض دی اکسید کربن حاد تحت عنوان هیپرکاپنیا ، زیر مجموعه ای از خفگی، گروه بندی می شوند .
از آنجایی که این گاز از هوا سنگینتر است، در مکانهایی که گاز از زمین تراوش میکند (به دلیل فعالیتهای آتشفشانی یا زمینگرمایی زیرسطحی) در غلظتهای نسبتاً بالا، بدون تأثیرات پراکنده باد، میتواند در مکانهای سرپناه/جیبدار زیر سطح متوسط زمین جمع شود. سطح، باعث خفگی حیوانات واقع در آن می شود. فیدرهای مردار جذب شده به لاشه ها نیز کشته می شوند. کودکان به همین روش در نزدیکی شهر گوما در اثر انتشار CO2 از کوه آتشفشان نزدیک نیراگونگو کشته شده اند . [48] اصطلاح سواحیلی برای این پدیده مازوکو است .

سازگاری با افزایش غلظت CO 2 در انسان اتفاق می افتد، از جمله تنفس اصلاح شده و تولید بی کربنات کلیه، به منظور متعادل کردن اثرات اسیدی شدن خون ( اسیدوز ). چندین مطالعه نشان داد که غلظت 2.0 درصد الهام گرفته شده را می توان برای فضاهای هوایی بسته (مثلاً یک زیردریایی ) استفاده کرد، زیرا سازگاری فیزیولوژیکی و برگشت پذیر است، زیرا بدتر شدن عملکرد یا فعالیت بدنی طبیعی در این سطح از قرار گرفتن در معرض برای پنج روز اتفاق نمی افتد. [49] [50] با این حال، مطالعات دیگر کاهش عملکرد شناختی را حتی در سطوح بسیار پایینتر نشان میدهند. [51] [52] همچنین، با اسیدوز تنفسی مداوم، سازوکارهای سازگاری یا جبرانی قادر به معکوس کردن چنین شرایطی نیستند .
زیر 1%
مطالعات کمی در مورد اثرات بهداشتی قرار گرفتن در معرض طولانی مدت مداوم CO 2 بر روی انسان و حیوانات در سطوح زیر 1٪ وجود دارد. محدودیت های مواجهه شغلی با CO 2 در ایالات متحده 0.5٪ (5000 ppm) برای یک دوره هشت ساعته تعیین شده است. [53] در این غلظت CO 2 ، خدمه ایستگاه فضایی بین المللی سردرد، بی حالی، کندی ذهنی، تحریک عاطفی، و اختلال خواب را تجربه کردند. [54] مطالعات روی حیوانات با 0.5٪ CO 2 کلسیفیکاسیون کلیه و از دست دادن استخوان پس از هشت هفته قرار گرفتن در معرض را نشان داده است. [55] مطالعهای بر روی انسانهایی که در جلسات 2.5 ساعته در معرض قرار گرفتند، اثرات منفی قابلتوجهی بر تواناییهای شناختی در غلظتهای کمتر از 0.1٪ (1000 ppm) CO2 نشان داد که احتمالاً به دلیل افزایش ناشی از CO2 در جریان خون مغزی است. [51] مطالعه دیگری کاهش در سطح فعالیت پایه و استفاده از اطلاعات را در 1000 ppm در مقایسه با 500 ppm مشاهده کرد. [52]
با این حال، مروری بر ادبیات نشان داد که یک زیرمجموعه قابل اعتماد از مطالعات در مورد پدیده دی اکسید کربن باعث ایجاد اختلال شناختی می شود که تنها تأثیر کمی بر تصمیم گیری در سطح بالا (برای غلظت های کمتر از 5000 ppm) نشان می دهد. بسیاری از مطالعات با طراحی ناکافی مطالعه، راحتی محیطی، عدم قطعیت در دوزهای قرار گرفتن در معرض و ارزیابیهای شناختی متفاوت مورد استفاده قرار گرفتند. [56] به طور مشابه، یک مطالعه در مورد اثرات غلظت CO 2 در کلاه ایمنی موتورسیکلت به دلیل داشتن روششناسی مشکوک در عدم توجه به گزارشهای خود راکبان موتورسیکلت و اندازهگیری با استفاده از مانکن مورد انتقاد قرار گرفته است. علاوه بر این، هنگامی که شرایط عادی موتورسیکلت به دست آمد (مانند سرعت بزرگراه یا شهر) یا گیره بالا رفت، غلظت CO 2 به سطوح ایمن (0.2٪) کاهش یافت. [57] [58]
| تمرکز | توجه داشته باشید |
|---|---|
| 280 ppm | سطوح ماقبل صنعتی |
| 421 ppm | سطوح فعلی (مه 2022). |
| 700ppm | توصیه ASHRAE [59] |
| 1000 پی پی ام | اختلال شناختی، محدودیت مواجهه طولانی مدت در کانادا [60] |
| 1000-2000 پی پی ام | خواب آلودگی [61] |
| 2000-5000 پی پی ام | سردرد، خواب آلودگی؛ تمرکز ضعیف، از دست دادن توجه، حالت تهوع خفیف نیز ممکن است [61] |
| 5000 پی پی ام | محدودیت قرار گرفتن در معرض 8 ساعت ایالات متحده [53] |
تهویه

تهویه ضعیف یکی از دلایل اصلی غلظت بیش از حد CO 2 در فضاهای بسته است که منجر به کیفیت پایین هوای داخلی می شود . دیاکسید کربن دیاکسید کربن بالاتر از غلظتهای بیرون در شرایط حالت پایدار (زمانی که اشغال و عملکرد سیستم تهویه به اندازهای طولانی است که غلظت CO 2 تثبیت شده است) گاهی برای تخمین نرخ تهویه برای هر نفر استفاده میشود. [ نیاز به نقل از ] غلظت بالاتر CO 2 با سلامتی سرنشینان، راحتی و کاهش عملکرد مرتبط است. [62] [63] نرخهای تهویه استاندارد ASHRAE 62.1–2007 ممکن است منجر به غلظتهای داخل ساختمان تا 2100 ppm بالاتر از شرایط محیط بیرون شود. بنابراین اگر غلظت خارج از منزل 400 ppm باشد، غلظت داخل ساختمان ممکن است به 2500 ppm برسد با نرخ تهویه که مطابق با استاندارد اجماع صنعت است. غلظت در فضاهای با تهویه ضعیف را می توان حتی بیشتر از این (محدوده 3000 یا 4000 ppm) یافت.
معدنچیانی که به دلیل تهویه ناکافی در معرض قرار گرفتن در معرض گاز هستند، به مخلوطهای دی اکسید کربن و نیتروژن به عنوان « نم سیاه »، «نم خفه کردن» یا «استیت» اشاره میکنند. قبل از توسعه فناوریهای مؤثرتر، معدنکاران مرتباً با آوردن قناری در قفس در حین کار ، سطوح خطرناک رطوبت سیاه و سایر گازها را در چاههای معدن بررسی میکردند . قناری نسبت به انسان به گازهای خفگی حساس تر است و با بیهوش شدن آواز خواندن را متوقف می کند و از جای خود می افتد. لامپ دیوی همچنین میتواند سطوح بالای رطوبت سیاه (که فرو میرود و در نزدیکی کف جمع میشود) را با سوزاندن روشنتر تشخیص دهد، در حالی که متان ، گاز خفهکننده دیگر و خطر انفجار، باعث میشود لامپ روشنتر بسوزد.
در فوریه 2020، سه نفر در یک مهمانی در مسکو بر اثر خفگی جان خود را از دست دادند، زیرا یخ خشک (CO 2 منجمد ) به یک استخر شنا اضافه شد تا آن را خنک کند. [64] حادثه مشابهی در سال 2018 رخ داد که زنی بر اثر دود CO 2 ناشی از مقدار زیادی یخ خشک که در ماشینش حمل می کرد جان باخت. [65]
هوای داخل خانه
انسان ها زمان بیشتری را در یک فضای محدود می گذرانند (حدود 80 تا 90 درصد زمان در یک ساختمان یا وسیله نقلیه). به گفته آژانس سلامت و ایمنی غذا، محیط زیست و شغلی فرانسه (ANSES) و بازیگران مختلف در فرانسه، میزان CO 2 در هوای داخلی ساختمان ها (مرتبط با سکونت انسان یا حیوان و وجود تاسیسات احتراق )، با وزن تجدید هوا، “معمولاً بین 350 تا 2500 ppm است”. [66]
در خانهها، مدارس، مهدکودکها و ادارات، هیچ رابطه سیستماتیکی بین سطوح CO 2 و سایر آلایندهها وجود ندارد و CO 2 داخلی از نظر آماری پیشبینیکننده خوبی برای آلایندههای مرتبط با ترافیک جادهای (یا هوا و غیره) در فضای باز نیست. [67] CO 2 پارامتری است که سریعترین تغییر را می دهد (با رطوبت سنجی و سطح اکسیژن هنگامی که انسان یا حیوانات در یک اتاق بسته یا تهویه ضعیف جمع می شوند). در کشورهای فقیر، بسیاری از اجاقهای باز منبع CO2 و CO هستند که مستقیماً به محیط زندگی ساطع میشوند. [68]
مناطق بیرونی با غلظت بالا
غلظت های محلی دی اکسید کربن می تواند در نزدیکی منابع قوی، به ویژه منابعی که توسط زمین های اطراف جدا شده اند، به مقادیر بالایی برسد. در چشمه آب گرم Bossoleto در نزدیکی Rapolano Terme در توسکانی ، ایتالیا، واقع در فرورفتگی کاسهای شکل به قطر حدود 100 متر (330 فوت)، غلظت CO2 در طول شب به بیش از 75٪ میرسد که برای کشتن حشرات و حیوانات کوچک کافی است. پس از طلوع خورشید، گاز توسط همرفت پراکنده می شود. [69] تصور میشود که غلظت بالای CO 2 حاصل از اختلال در آب عمیق دریاچه اشباع شده با CO 2 باعث 37 مرگ در دریاچه مونون ، کامرون در سال 1984 و 1700 تلفات در دریاچه نیوس ، کامرون در سال 1986 شده است . [70]
فیزیولوژی انسان
محتوا
| محفظه خون | ( کیلو پاسکال ) | ( میلی متر جیوه ) | |
|---|---|---|---|
| دی اکسید کربن خون وریدی | 5.5-6.8 | 41-51 [71] | 41-51 [71] |
| فشار گاز ریوی آلوئولی | 4.8 | 36 | 36 |
| دی اکسید کربن خون شریانی | 4.7-6.0 | 35-45 [71] | 35-45 [71] |
بدن تقریباً 2.3 پوند (1.0 کیلوگرم) دی اکسید کربن در روز برای هر فرد تولید می کند، [72] که حاوی 0.63 پوند (290 گرم) کربن است.در انسان، این دیاکسید کربن از طریق سیستم وریدی منتقل میشود و از طریق ریهها تنفس میشود و در نتیجه غلظت کمتری در شریانها ایجاد میشود . محتوای دی اکسید کربن خون اغلب به عنوان فشار جزئی داده می شود ، که فشاری است که اگر دی اکسید کربن به تنهایی حجم را اشغال می کرد، داشت. [73] در انسان، محتوای دی اکسید کربن خون در جدول مجاور نشان داده شده است.
انتقال در خون
CO 2 در خون به سه روش مختلف حمل می شود. (درصد دقیق بین خون شریانی و وریدی متفاوت است).
- اکثریت (حدود 70٪ تا 80٪) به یون های بی کربنات HCO تبدیل می شود-3توسط آنزیم کربنیک انیدراز در گلبول های قرمز، [74] توسط واکنش:
- CO 2 + H 2 O → H 2 CO 3 → H + + HCO-3
- 5-10٪ در پلاسمای خون حل می شود [74]
- 5 تا 10 درصد به عنوان ترکیبات کربامینو به هموگلوبین متصل می شود [74]
هموگلوبین ، مولکول اصلی حامل اکسیژن در گلبول های قرمز ، هم اکسیژن و هم دی اکسید کربن را حمل می کند. با این حال، CO 2 متصل به هموگلوبین به همان محل اکسیژن متصل نمی شود. در عوض، با گروه های ترمینال N در چهار زنجیره گلوبین ترکیب می شود. با این حال، به دلیل اثرات آلوستریک روی مولکول هموگلوبین، اتصال CO 2 باعث کاهش مقدار اکسیژنی می شود که برای فشار جزئی اکسیژن محدود می شود. این به عنوان اثر Haldane شناخته می شود و در انتقال دی اکسید کربن از بافت ها به ریه ها مهم است. برعکس، افزایش فشار جزئی CO 2 یا pH پایین تر باعث تخلیه اکسیژن از هموگلوبین می شود که به عنوان اثر بور شناخته می شود .
تنظیم تنفس
دی اکسید کربن یکی از واسطه های خودتنظیم موضعی خون رسانی است. اگر غلظت آن بالا باشد، مویرگها منبسط میشوند تا جریان خون بیشتری به آن بافت ایجاد شود. [75]
یون های بی کربنات برای تنظیم pH خون بسیار مهم هستند. سرعت تنفس یک فرد بر سطح CO 2 در خون او تأثیر می گذارد. تنفس خیلی آهسته یا کم عمق باعث اسیدوز تنفسی می شود ، در حالی که تنفس خیلی سریع منجر به هیپرونتیلاسیون می شود که می تواند باعث آلکالوز تنفسی شود . [76]
اگرچه بدن برای متابولیسم به اکسیژن نیاز دارد، سطوح پایین اکسیژن معمولاً تنفس را تحریک نمی کند. در عوض، تنفس توسط سطوح بالاتر دی اکسید کربن تحریک می شود. در نتیجه، تنفس هوای کم فشار یا مخلوط گازی بدون اکسیژن (مانند نیتروژن خالص) میتواند منجر به از دست دادن هوشیاری بدون احساس گرسنگی هوا شود . این امر به ویژه برای خلبانان جنگنده در ارتفاع بالا خطرناک است. همچنین به همین دلیل است که مهمانداران هواپیما به مسافران دستور می دهند در صورت از دست دادن فشار کابین، قبل از کمک به دیگران، ابتدا ماسک اکسیژن را روی خود بمالند . در غیر این صورت، خطر از دست دادن هوشیاری وجود دارد. [74]
مراکز تنفسی سعی می کنند فشار CO 2 شریانی را 40 میلی متر جیوه حفظ کنند . با هیپرونتیلاسیون عمدی، محتوای CO 2 خون شریانی ممکن است به 10-20 میلیمتر جیوه کاهش یابد (محتوای اکسیژن خون کمی تحت تأثیر قرار میگیرد)، و نیروی تنفسی کاهش مییابد. به همین دلیل است که فرد می تواند پس از هیپرونتیلاسیون بیشتر از بدون هیپرونتیله نفس خود را حبس کند. این خطر را به همراه دارد که قبل از اینکه نیاز به نفس کشیدن زیاد شود، بیهوشی ایجاد شود، به همین دلیل است که تهویه بیش از حد قبل از غواصی آزاد خطرناک است. [77]
تمرکز و نقش در محیط
جو

در اتمسفر زمین ، دی اکسید کربن یک گاز کمیاب است که نقش مهمی در اثر گلخانه ای ، چرخه کربن ، فتوسنتز و چرخه کربن اقیانوسی ایفا می کند . این یکی از چندین گاز گلخانه ای در جو زمین است . میانگین غلظت جهانی CO 2 فعلی در اتمسفر 421 ppm تا می 2022 (0.04٪) است. [80] این افزایش 50 درصدی از زمان شروع انقلاب صنعتی است ، از 280 ppm در طول 10000 سال قبل از اواسط قرن 18. [81] [80] [82] این افزایش به دلیل فعالیت انسانی است . [83] سوزاندن سوخت های فسیلی علت اصلی افزایش غلظت CO 2 و همچنین علت اصلی تغییرات آب و هوایی است. [84] دیگر منابع بزرگ انسانی شامل تولید سیمان ، جنگل زدایی و سوزاندن زیست توده است .
در حالی که برای نور مرئی شفاف است، دی اکسید کربن یک گاز گلخانه ای است که تابش مادون قرمز را در دو فرکانس ارتعاشی فعال مادون قرمز جذب و منتشر می کند. CO 2 تابش مادون قرمز را در طول موج های 4.26 میکرومتر (2347 سانتی متر در 1 ) ( حالت ارتعاشی کششی نامتقارن ) و 14.99 میکرومتر (667 سانتی متر -1 ) (حالت ارتعاشی خمشی) جذب کرده و ساطع می کند . نقش مهمی در تأثیرگذاری بر دمای سطح زمین از طریق اثر گلخانه ای دارد . [85] گسیل نور از سطح زمین در ناحیه فروسرخ بین 200 تا 2500 سانتیمتر مربع شدیدتر است ، [86] برخلاف تابش نور از خورشید بسیار داغتر که در ناحیه مرئی شدیدتر است. جذب نور مادون قرمز در فرکانس های ارتعاشی CO 2 اتمسفر انرژی را در نزدیکی سطح به دام می اندازد و سطح و پایین اتمسفر را گرم می کند. انرژی کمتری به اتمسفر فوقانی می رسد که به دلیل این جذب خنک تر است. [87]
افزایش غلظت CO 2 اتمسفر و سایر گازهای گلخانه ای با عمر طولانی مانند متان ، اکسید نیتروژن و ازن باعث افزایش جذب و انتشار تشعشعات مادون قرمز توسط جو می شود و باعث افزایش مشاهده شده در دمای متوسط جهانی و اسیدی شدن اقیانوس ها می شود . اثر مستقیم دیگر اثر لقاح CO2 است . این تغییرات باعث ایجاد طیفی از اثرات غیرمستقیم تغییر اقلیم بر محیط فیزیکی، اکوسیستم ها و جوامع انسانی می شود. دی اکسید کربن تأثیر گرمایش کلی بیشتری نسبت به سایر گازهای گلخانه ای دارد. [82] این یک عمر جوی دارد که با مقدار تجمعی کربن فسیلی استخراج شده و سوزانده شده، به دلیل عدم تعادلی که این فعالیت بر چرخه سریع کربن زمین تحمیل کرده است، افزایش می یابد . [88] این بدان معنی است که بخشی (20 تا 35 درصد پیشبینیشده) از کربن فسیلی که تاکنون منتقل شده است، هزاران سال پس از شروع کاهش فعالیتهای انتقال کربن، بهعنوان سطوح CO2 بالا در جو باقی میماند. [89] [90] [91] چرخه کربن یک چرخه بیوژئوشیمیایی است که در آن کربن بین اقیانوسها ، خاک، سنگها و بیوسفر زمین مبادله میشود . گیاهان و سایر فوتواتوتروف ها از انرژی خورشیدی برای تولید کربوهیدرات از دی اکسید کربن اتمسفر و آب توسط فتوسنتز استفاده می کنند . تقریباً همه موجودات دیگر به کربوهیدرات حاصل از فتوسنتز به عنوان منبع اصلی انرژی و ترکیبات کربنی خود وابسته هستند.
غلظت کنونی CO 2 در اتمسفر بالاترین میزان در 14 میلیون سال گذشته است. [92] غلظت CO 2 در جو در طول دوره کامبرین حدود 500 میلیون سال پیش به 4000 ppm و در طول یخبندان کواترنر در دو میلیون سال گذشته به 180 ppm رسید. [81] رکوردهای دمایی بازسازی شده برای 420 میلیون سال گذشته نشان می دهد که غلظت CO 2 اتمسفر تقریباً در 2000 پی پی ام در طول دوره دونین (400 میلیون سال) و دوباره در دوره تریاس (220-200 میلیون سال) به اوج خود رسید و چهار برابر شد. سطوح فعلی در طول دوره ژوراسیک (201-145 میلیون سال). [93] [94]
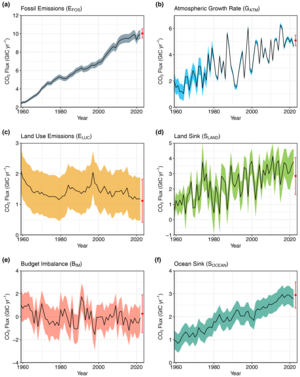
اقیانوس ها
اسیدی شدن اقیانوس
دی اکسید کربن در اقیانوس حل می شود و اسید کربنیک ( H2CO3 )، بی کربنات ( HCO ) را تشکیل می دهد .-3و کربنات ( CO2-3). حدود پنجاه برابر دی اکسید کربن محلول در اقیانوس ها در جو وجود دارد. اقیانوس ها به عنوان یک مخزن کربن عظیم عمل می کنند و حدود یک سوم CO2 منتشر شده از فعالیت های انسانی را به خود اختصاص داده اند . [96]
اسیدی شدن اقیانوس کاهش pH اقیانوس زمین است . بین سالهای 1950 تا 2020، میانگین pH سطح اقیانوس از تقریباً 8.15 به 8.05 کاهش یافت. [97] انتشار دی اکسید کربن از فعالیت های انسانی علت اصلی اسیدی شدن اقیانوس ها است، با سطح دی اکسید کربن اتمسفر (CO 2 ) بیش از 410 ppm (در سال 2020). CO2 از جو توسط اقیانوس ها جذب می شود. این باعث تولید اسید کربنیک ( H2CO3 ) می شود که به یک یون بی کربنات ( HCO) تجزیه می شود .-3و یک یون هیدروژن ( H + ). وجود یونهای هیدروژن آزاد ( H + ) pH اقیانوس را کاهش میدهد و اسیدیته را افزایش میدهد (این بدان معنا نیست که آب دریا هنوز اسیدی است، اما همچنان قلیایی است و PH بالاتر از 8 دارد). موجودات آهکی ساز دریایی ، مانند نرم تنان و مرجان ها ، به ویژه آسیب پذیر هستند زیرا برای ساختن پوسته و اسکلت به کربنات کلسیم متکی هستند. [98]
تغییر pH به میزان 0.1 نشان دهنده افزایش 26 درصدی غلظت یون هیدروژن در اقیانوس های جهان است (مقیاس pH لگاریتمی است، بنابراین تغییر یک واحد pH معادل تغییر 10 برابری در غلظت یون هیدروژن است). PH سطح دریا و حالت های اشباع کربناته بسته به عمق و موقعیت اقیانوس متفاوت است. آب های سردتر و عرض جغرافیایی بالاتر قادر به جذب CO 2 بیشتری هستند . این می تواند باعث افزایش اسیدیته، کاهش pH و سطوح اشباع کربنات در این مناطق شود. سایر عواملی که بر تبادل CO 2 جو-اقیانوس و در نتیجه اسیدی شدن محلی اقیانوس تأثیر میگذارند عبارتند از: جریانهای اقیانوسی و مناطق بالارونده ، نزدیکی به رودخانههای بزرگ قارهای، پوشش یخ دریا ، و تبادل اتمسفر با نیتروژن و گوگرد حاصل از سوزاندن سوختهای فسیلی و کشاورزی . [99] [100] [101]

تغییرات در شیمی اقیانوس ها می تواند اثرات مستقیم و غیرمستقیم گسترده ای بر موجودات زنده و زیستگاه آنها داشته باشد. یکی از مهم ترین پیامدهای افزایش اسیدیته اقیانوس ها به تولید پوسته از کربنات کلسیم ( CaCO 3 ) مربوط می شود. [98] این فرآیند کلسیفیکاسیون نامیده می شود و برای زیست شناسی و بقای طیف وسیعی از موجودات دریایی مهم است. کلسیفیکاسیون شامل رسوب یون های محلول به ساختارهای CaCO 3 جامد است ، ساختارهایی برای بسیاری از موجودات دریایی ، مانند کوکولیتوفورها ، روزن داران ، سخت پوستان ، نرم تنان و غیره . غلظت یون های کربنات ( CO2-3).
مقدار بسیار کمی از دی اکسید کربن اضافی که به اقیانوس اضافه می شود به صورت دی اکسید کربن محلول باقی می ماند. اکثریت به بی کربنات اضافی و یون های هیدروژن آزاد تجزیه می شوند. افزایش هیدروژن بزرگتر از افزایش بی کربنات است، [102] باعث ایجاد عدم تعادل در واکنش می شود:
- HCO-3⇌ CO2-3+ H +
برای حفظ تعادل شیمیایی، برخی از یونهای کربنات موجود در اقیانوس با برخی از یونهای هیدروژن ترکیب میشوند تا بیکربنات بیشتری بسازند. بنابراین غلظت یونهای کربنات اقیانوس کاهش مییابد و یک بلوک ساختمانی ضروری برای موجودات دریایی برای ساختن پوسته یا کلسیفیه کردن حذف میشود:
- Ca 2 + + CO2-3⇌CaCO3 _
دریچه های هیدروترمال
دی اکسید کربن نیز از طریق دریچه های گرمابی به اقیانوس ها وارد می شود. دریچه هیدروترمال شامپاین که در آتشفشان شمال غربی ایفوکو در گودال ماریانا یافت می شود، دی اکسید کربن مایع تقریبا خالص تولید می کند، که یکی از تنها دو مکان شناخته شده در جهان تا سال 2004 است، و دیگری در ناوگان اوکیناوا است . [103] کشف یک دریاچه زیردریایی از دی اکسید کربن مایع در اوکیناوا در سال 2006 گزارش شد. [104]
تولید
فرآیندهای بیولوژیکی
دی اکسید کربن محصول جانبی تخمیر شکر در دم کردن آبجو ، ویسکی و سایر مشروبات الکلی و در تولید بیواتانول است . مخمر قند را برای تولید CO 2 و اتانول که به نام الکل نیز شناخته می شود به شرح زیر متابولیزه می کند:
- C 6 H 12 O 6 → 2 CO 2 + 2 CH 3 CH 2 OH
همه موجودات هوازی زمانی که کربوهیدرات ها ، اسیدهای چرب و پروتئین ها را اکسید می کنند ، CO 2 تولید می کنند . تعداد زیادی از واکنش های درگیر بسیار پیچیده هستند و به راحتی توصیف نمی شوند. رجوع به ( تنفس سلولی ، تنفس بی هوازی و فتوسنتز ) شود. معادله تنفس گلوکز و سایر مونوساکاریدها به صورت زیر است:
- C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O
موجودات بی هوازی مواد آلی را تجزیه می کنند و متان و دی اکسید کربن را همراه با ردپایی از ترکیبات دیگر تولید می کنند. [105] صرف نظر از نوع مواد آلی، تولید گازها از الگوی جنبشی به خوبی تعریف شده پیروی می کند . دی اکسید کربن حدود 40 تا 45 درصد از گازی را تشکیل می دهد که از تجزیه در محل های دفن زباله (به نام ” گاز محل دفن زباله “) خارج می شود. بیشتر 50 تا 55 درصد باقیمانده متان است. [106]
فرایندهای صنعتی
دی اکسید کربن را می توان با تقطیر از هوا به دست آورد، اما این روش ناکارآمد است. از نظر صنعتی، دی اکسید کربن عمدتاً یک محصول پسماند بازیابی نشده است که با چندین روش تولید می شود که ممکن است در مقیاس های مختلف انجام شود. [107]
احتراق
احتراق تمام سوختهای مبتنی بر کربن مانند متان ( گاز طبیعی )، تقطیرهای نفتی ( بنزین ، گازوئیل ، نفت سفید ، پروپان )، زغالسنگ، چوب و مواد آلی عمومی، دی اکسید کربن تولید میکند و به جز در مورد کربن خالص، آب تولید میکند. . به عنوان مثال، واکنش شیمیایی بین متان و اکسیژن :
- CH 4 + 2 O 2 → CO 2 + 2 H 2 O
آهن از اکسیدهای آن با کک در یک کوره بلند احیا می شود و آهن خام و دی اکسید کربن تولید می کند: [108]
- Fe 2 O 3 + 3 CO → 3 CO 2 + 2 Fe
محصول جانبی حاصل از تولید هیدروژن
دی اکسید کربن محصول جانبی تولید صنعتی هیدروژن با رفرمینگ بخار و واکنش جابجایی گاز آب در تولید آمونیاک است . این فرآیندها با واکنش آب و گاز طبیعی (عمدتاً متان) آغاز می شود. [109] این منبع اصلی دی اکسید کربن درجه غذایی برای استفاده در کربناته کردن آبجو و نوشابه است ، و همچنین برای حیوانات خیره کننده مانند طیور استفاده می شود . در تابستان 2018 به دلیل تعطیلی موقت چندین کارخانه آمونیاک برای نگهداری، کمبود دی اکسید کربن برای این اهداف در اروپا به وجود آمد. [110]
تجزیه حرارتی سنگ آهک
از تجزیه حرارتی سنگ آهک، CaCO 3 با حرارت دادن ( کلسینه کردن ) در حدود 850 درجه سانتیگراد (1560 درجه فارنهایت)، در ساخت آهک زنده ( اکسید کلسیم ، CaO)، ترکیبی که مصارف صنعتی زیادی دارد، تولید میشود :
- CaCO 3 → CaO + CO 2
اسیدها CO 2 را از بیشتر کربنات های فلزی آزاد می کنند. در نتیجه، ممکن است مستقیماً از چشمههای دی اکسید کربن طبیعی به دست آید ، جایی که از اثر آب اسیدی شده روی سنگ آهک یا دولومیت تولید میشود . واکنش بین اسید هیدروکلریک و کربنات کلسیم (سنگ آهک یا گچ) در زیر نشان داده شده است:
- CaCO 3 + 2 HCl → CaCl 2 + H 2 CO 3
سپس اسید کربنیک (H 2 CO 3 ) به آب و CO 2 تجزیه می شود :
- H 2 CO 3 → CO 2 + H 2 O
با آزاد شدن گاز، چنین واکنش هایی با ایجاد کف یا حباب یا هر دو همراه است. آنها کاربردهای گسترده ای در صنعت دارند زیرا می توان از آنها برای خنثی کردن جریان های اسیدی زباله استفاده کرد.
مصارف تجاری
دی اکسید کربن در صنایع غذایی، صنایع نفت و صنایع شیمیایی استفاده می شود. [107] این ترکیب کاربردهای تجاری مختلفی دارد، اما یکی از بزرگترین کاربردهای آن به عنوان یک ماده شیمیایی در تولید نوشیدنی های گازدار است. این درخشش را در نوشیدنی های گازدار مانند آب سودا، آبجو و شراب گازدار ایجاد می کند.
پیش ساز مواد شیمیایی
|
این بخش نیاز به گسترش دارد . می توانید با افزودن به آن کمک کنید . ( ژوئیه 2014 )
|
در صنایع شیمیایی، دی اکسید کربن عمدتاً به عنوان یک ماده تشکیل دهنده در تولید اوره مصرف می شود و بخش کوچکتری برای تولید متانول و طیف وسیعی از محصولات دیگر استفاده می شود. [111] برخی از مشتقات کربوکسیلیک اسید مانند سالیسیلات سدیم با استفاده از CO2 توسط واکنش Kolbe-Schmitt تهیه می شوند . [112]
علاوه بر فرآیندهای مرسوم با استفاده از CO2 برای تولید مواد شیمیایی، روش های الکتروشیمیایی نیز در سطح تحقیقاتی مورد بررسی قرار می گیرند. به طور خاص، استفاده از انرژی های تجدیدپذیر برای تولید سوخت از CO 2 (مانند متانول) جذاب است زیرا این می تواند منجر به سوخت هایی شود که به راحتی می توانند در فن آوری های احتراق مرسوم حمل و نقل و استفاده شوند اما انتشار خالص CO 2 ندارند . [113]
کشاورزی
گیاهان برای انجام فتوسنتز به دی اکسید کربن نیاز دارند. اتمسفر گلخانه ها ممکن است (اگر اندازه بزرگ باشد، باید) با CO2 اضافی برای حفظ و افزایش سرعت رشد گیاه غنی شود . [114] [115] در غلظت های بسیار بالا (100 برابر غلظت اتمسفر یا بیشتر)، دی اکسید کربن می تواند برای حیوانات سمی باشد، بنابراین افزایش غلظت به 10000 ppm (1%) یا بیشتر برای چند ساعت، آفاتی مانند مگس های سفید و کنه های عنکبوتی در گلخانه. [116]
خوراکی ها

دی اکسید کربن یک افزودنی غذایی است که به عنوان پیشران و تنظیم کننده اسیدیته در صنایع غذایی استفاده می شود. این برای استفاده در اتحادیه اروپا [117] (فهرست شده با شماره E290)، ایالات متحده [118] و استرالیا و نیوزیلند [119] (فهرست شده توسط شماره INS آن 290) تایید شده است.
آب نباتی به نام Pop Rocks با گاز دی اکسید کربن [120] در حدود 4000 کیلو پاسکال (40 بار ؛ 580 psi ) تحت فشار قرار می گیرد. هنگامی که در دهان قرار می گیرد، حل می شود (درست مانند سایر آب نبات های سخت) و حباب های گاز را با صدایی قابل شنیدن آزاد می کند.
خمیرمایه ها با تولید دی اکسید کربن باعث بالا آمدن خمیر می شوند. [121] مخمر نانوایی با تخمیر قندها در خمیر دی اکسید کربن تولید می کند، در حالی که مخمرهای شیمیایی مانند بیکینگ پودر و جوش شیرین هنگام گرم شدن یا در معرض اسیدها ، دی اکسید کربن آزاد می کنند .
نوشیدنی ها
دی اکسید کربن برای تولید نوشابه های گازدار و آب سودا استفاده می شود . به طور سنتی، کربناته شدن آبجو و شراب گازدار از طریق تخمیر طبیعی اتفاق میافتد، اما بسیاری از تولیدکنندگان این نوشیدنیها را با دیاکسید کربن بازیافتشده از فرآیند تخمیر کربناته میکنند. در مورد ماءالشعیر بطری و بشکه ای، رایج ترین روش مورد استفاده، کربناته کردن با دی اکسید کربن بازیافتی است. به استثنای آبجوی واقعی بریتانیایی ، آبجو آبجو معمولاً با استفاده از دی اکسید کربن تحت فشار، که گاهی با نیتروژن مخلوط می شود، از بشکه های موجود در اتاق سرد یا زیرزمین به شیرهای پخش روی میله منتقل می شود.
مزه آب سودا (و احساس طعم مرتبط در سایر نوشیدنی های گازدار) به جای ترکیدن حباب های گاز ناشی از دی اکسید کربن محلول است. کربنیک انیدراز 4 به اسید کربنیک تبدیل می شود که منجر به طعم ترش می شود و همچنین دی اکسید کربن محلول باعث واکنش حسی جسمی می شود . [122]
شراب سازی

دی اکسید کربن به شکل یخ خشک اغلب در مرحله خیساندن سرد در شراب سازی برای خنک کردن سریع خوشه های انگور پس از چیدن برای کمک به جلوگیری از تخمیر خود به خود توسط مخمر وحشی استفاده می شود . مزیت اصلی استفاده از یخ خشک نسبت به یخ آبی این است که انگور را بدون افزودن آب اضافی خنک می کند که ممکن است غلظت قند موجود در انگور و در نتیجه غلظت الکل در شراب تمام شده را کاهش دهد. دی اکسید کربن همچنین برای ایجاد یک محیط کم اکسیژن برای خیساندن کربنیک استفاده می شود ، فرآیندی که برای تولید شراب Beaujolais استفاده می شود.
دی اکسید کربن گاهی اوقات برای پر کردن بطری های شراب یا سایر ظروف ذخیره سازی مانند بشکه ها برای جلوگیری از اکسیداسیون استفاده می شود، اگرچه این مشکل وجود دارد که می تواند در شراب حل شود و شرابی که قبلاً ساکن بود کمی گازدار شود. به همین دلیل، گازهای دیگری مانند نیتروژن یا آرگون برای این فرآیند توسط شراب سازان حرفه ای ترجیح داده می شوند.
حیوانات خیره کننده
دی اکسید کربن اغلب برای “بیهوش کردن” حیوانات قبل از کشتار استفاده می شود. [123] «حیرتانگیز» ممکن است نام اشتباهی باشد، زیرا حیوانات فوراً ناک اوت نمیشوند و ممکن است دچار ناراحتی شوند. [124] [125]
گاز بی اثر
دی اکسید کربن یکی از رایج ترین گازهای فشرده برای سیستم های پنوماتیک (گاز تحت فشار) در ابزارهای فشار قابل حمل است. دی اکسید کربن نیز به عنوان جو برای جوشکاری استفاده می شود ، اگرچه در قوس جوشکاری، برای اکسید شدن بیشتر فلزات واکنش نشان می دهد. با وجود شواهد قابل توجهی مبنی بر اینکه جوش های ساخته شده در دی اکسید کربن شکننده تر از جوش هایی هستند که در اتمسفرهای خنثی تر ساخته می شوند، استفاده در صنعت خودرو رایج است . [ نیاز به ذکر منبع ] هنگامی که برای جوشکاری MIG استفاده می شود ، استفاده از CO 2 گاهی اوقات به عنوان جوشکاری MAG برای گاز فعال فلزی نامیده می شود، زیرا CO 2 می تواند در این دماهای بالا واکنش نشان دهد. تمایل به تولید یک گودال داغتر از جوهای واقعاً بی اثر دارد و ویژگی های جریان را بهبود می بخشد. اگرچه، این ممکن است به دلیل واکنش های جوی باشد که در محل گودال رخ می دهد. این معمولاً برعکس اثر مورد نظر هنگام جوشکاری است، زیرا تمایل به شکننده شدن محل دارد، اما ممکن است برای جوشکاری معمولی فولاد ملایم، جایی که شکلپذیری نهایی نگرانی اصلی نیست، مشکلی ایجاد نکند.
دی اکسید کربن در بسیاری از محصولات مصرفی که به گاز تحت فشار نیاز دارند استفاده می شود زیرا ارزان و غیر قابل اشتعال است و به دلیل اینکه در دمای اتاق با فشار قابل دسترس تقریباً 60 بار (870 psi ؛ 59 atm ) در معرض انتقال فاز از گاز به مایع قرار می گیرد. دی اکسید کربن بسیار بیشتری برای جا دادن در یک ظرف معین نسبت به موارد دیگر. جلیقه نجات اغلب حاوی قوطی های دی اکسید کربن تحت فشار برای باد کردن سریع است. کپسول های آلومینیومی CO 2 نیز به عنوان منبع گاز فشرده برای تفنگ بادی ، نشانگر /تفنگ پینت بال، باد کردن لاستیک دوچرخه و برای ساخت آب گازدار فروخته می شود . غلظت بالای دی اکسید کربن نیز می تواند برای از بین بردن آفات استفاده شود. دی اکسید کربن مایع در خشک کردن فوق بحرانی برخی از محصولات غذایی و مواد تکنولوژیکی، در تهیه نمونه ها برای میکروسکوپ الکترونی روبشی [126] و در کافئین زدایی دانه های قهوه استفاده می شود .
کپسول آتش نشانی

از دی اکسید کربن می توان برای خاموش کردن شعله ها با سیل کردن محیط اطراف شعله با گاز استفاده کرد. خود برای خاموش کردن شعله واکنشی نشان نمی دهد، بلکه با جابجایی شعله اکسیژن، آن را از بین می برد. برخی از کپسول های آتش نشانی ، به ویژه آنهایی که برای آتش سوزی های الکتریکی طراحی شده اند ، حاوی دی اکسید کربن مایع تحت فشار هستند. خاموش کننده های دی اکسید کربن در آتش سوزی های کوچک مایع قابل اشتعال و الکتریکی به خوبی کار می کنند، اما در آتش سوزی های معمولی قابل احتراق نیستند، زیرا مواد در حال سوختن را به میزان قابل توجهی خنک نمی کنند و هنگامی که دی اکسید کربن پراکنده می شود، در اثر قرار گرفتن در معرض اکسیژن اتمسفر می توانند آتش بگیرند . آنها عمدتا در اتاق سرور استفاده می شوند. [127]
دی اکسید کربن همچنین به طور گسترده ای به عنوان یک عامل خاموش کننده در سیستم های ثابت حفاظت از حریق برای کاربرد محلی خطرات خاص و سیل کامل یک فضای حفاظت شده استفاده شده است. [128] استانداردهای سازمان بین المللی دریانوردی سیستم های دی اکسید کربن را برای حفاظت در برابر آتش انبارهای کشتی و موتورخانه ها به رسمیت می شناسند. سیستم های حفاظت در برابر آتش مبتنی بر دی اکسید کربن با چندین مرگ مرتبط است، زیرا می تواند در غلظت های به اندازه کافی بالا باعث خفگی شود. بررسی سیستم های CO 2 51 حادثه را بین سال 1975 تا تاریخ گزارش (2000) شناسایی کرد که باعث 72 مرگ و 145 زخمی شد. [129]
CO 2 فوق بحرانی به عنوان حلال
دی اکسید کربن مایع یک حلال خوب برای بسیاری از ترکیبات آلی چربی دوست است و برای حذف کافئین از قهوه استفاده می شود . [18] دی اکسید کربن در صنایع دارویی و سایر صنایع فرآوری شیمیایی به عنوان جایگزینی کمتر سمی برای حلال های سنتی تر مانند ارگانوکلریدها توجه را به خود جلب کرده است . به همین دلیل توسط برخی از خشکشویی ها نیز استفاده می شود . در تهیه برخی از آئروژل ها به دلیل خواص دی اکسید کربن فوق بحرانی استفاده می شود.
مصارف پزشکی و دارویی
در پزشکی تا 5 درصد دی اکسید کربن (130 برابر غلظت اتمسفر) برای تحریک تنفس پس از آپنه و برای تثبیت تعادل O 2 / CO 2 در خون به اکسیژن اضافه می شود.
دی اکسید کربن را می توان با حداکثر 50٪ اکسیژن مخلوط کرد و یک گاز قابل استنشاق را تشکیل داد. این به عنوان Carbogen شناخته می شود و کاربردهای پزشکی و تحقیقاتی مختلفی دارد.
یکی دیگر از کاربردهای پزشکی ، آبگرم های خشک موفت است که از دی اکسید کربن حاصل از تخلیه پس از آتشفشان برای اهداف درمانی استفاده می کنند.
انرژی
CO 2 فوق بحرانی به عنوان سیال عامل در موتور چرخه قدرت Allam استفاده می شود .
بازیابی سوخت های فسیلی
دی اکسید کربن در افزایش بازیافت نفت در جایی که به چاه های نفت تولید یا در مجاورت آن تزریق می شود، معمولاً در شرایط فوق بحرانی ، زمانی که با نفت قابل اختلاط می شود، استفاده می شود. این رویکرد میتواند با کاهش اشباع روغن باقیمانده به میزان ۷ تا ۲۳ درصد علاوه بر استخراج اولیه ، بازیافت روغن اصلی را افزایش دهد . [130] این ماده هم به عنوان یک عامل فشار عمل می کند و هم وقتی در نفت خام زیرزمینی حل می شود ، ویسکوزیته آن را به میزان قابل توجهی کاهش می دهد و تغییر شیمی سطح نفت را قادر می سازد تا با سرعت بیشتری از مخزن به سمت چاه برداشته شود. [131] در میادین نفتی بالغ، از شبکه های لوله گسترده برای حمل دی اکسید کربن به نقاط تزریق استفاده می شود.
در بازیافت متان بستر زغالسنگ ، دیاکسید کربن به درون درز زغالسنگ پمپ میشود تا متان را جابجا کند، برخلاف روشهای فعلی که عمدتاً بر حذف آب (برای کاهش فشار) تکیه میکنند تا درز زغالسنگ متان به دام افتاده خود را آزاد کند. [132]
تبدیل زیستی به سوخت
پیشنهاد شده است که CO 2 حاصل از تولید برق به حوضچه ها منتقل شود تا رشد جلبک ها را تحریک کند که سپس می تواند به سوخت بیودیزل تبدیل شود . [133] سویهای از سیانوباکتری Synechococcus elongatus به طور ژنتیکی برای تولید سوختهای ایزوبوتیرآلدئید و ایزوبوتانول از CO2 با استفاده از فتوسنتز مهندسی شده است. [134]
محققان فرآیندی به نام الکترولیز را توسعه دادهاند که از آنزیمهای جدا شده از باکتریها برای نیرو دادن به واکنشهای شیمیایی که CO2 را به سوخت تبدیل میکنند، استفاده میکنند . [135] [136] [137]
مبرد

دی اکسید کربن مایع و جامد مبردهای مهمی هستند ، به ویژه در صنایع غذایی، جایی که در حمل و نقل و نگهداری بستنی و سایر مواد غذایی منجمد استفاده می شوند. دی اکسید کربن جامد “یخ خشک” نامیده می شود و برای محموله های کوچک که تجهیزات تبرید در آنها کاربردی نیست استفاده می شود. دی اکسید کربن جامد در فشار اتمسفر معمولی، صرف نظر از دمای هوا، همیشه زیر 78.5- درجه سانتی گراد (-109.3 درجه فارنهایت) است.
دی اکسید کربن مایع (نامگذاری صنعتی R744 یا R-744) به عنوان مبرد قبل از استفاده از دی کلرودی فلورومتان (R12، یک ترکیب کلروفلوروکربن (CFC) [ نیاز به منبع ] استفاده شد . CO 2 ممکن است از یک رنسانس لذت ببرد زیرا یکی از جایگزین های اصلی CFC ها، 1،1،1،2-tetrafluoroethane ( R134a ، یک ترکیب هیدروفلوئوروکربن (HFC)) بیش از CO2 به تغییرات آب و هوایی کمک می کند . خواص فیزیکی CO 2 برای اهداف سرمایش، تبرید و گرمایش بسیار مطلوب است و ظرفیت خنک کنندگی حجمی بالایی دارد. با توجه به نیاز به کار در فشارهای تا 130 بار (1900 psi؛ 13000 کیلو پاسکال)، سیستم های CO 2 به مخازن و قطعات بسیار مقاوم مکانیکی نیاز دارند که قبلاً برای تولید انبوه در بسیاری از بخش ها توسعه یافته اند. در تهویه مطبوع خودرو، در بیش از 90 درصد از تمام شرایط رانندگی در عرض های جغرافیایی بالاتر از 50 درجه، CO 2 (R744) کارآمدتر از سیستم هایی که از HFC استفاده می کنند (به عنوان مثال، R134a) عمل می کند. مزایای زیست محیطی آن ( GWP 1، غیر تخریب کننده لایه لایه اوزون، غیر سمی، غیر قابل اشتعال) می تواند آن را تبدیل به سیال کاری آینده برای جایگزینی HFC های فعلی در اتومبیل ها، سوپرمارکت ها و آبگرمکن های پمپ حرارتی کند. کوکاکولا خنک کننده های نوشیدنی مبتنی بر CO 2 را تولید کرده است و ارتش ایالات متحده به فن آوری تبرید و گرمایش CO 2 علاقه مند است. [138] [139]
استفاده های جزئی

دی اکسید کربن محیط لیزر در لیزر دی اکسید کربن است که یکی از قدیمی ترین نوع لیزرها است.
دی اکسید کربن می تواند به عنوان وسیله ای برای کنترل pH استخرها، [140] با افزودن مداوم گاز به آب، در نتیجه از افزایش pH استفاده شود. از جمله مزایای این امر اجتناب از دست زدن به اسیدهای (خطرناک تر) است. به طور مشابه، در آکواریوم های صخره ای نیز استفاده می شود ، جایی که معمولاً در راکتورهای کلسیم برای کاهش موقت pH آب عبوری از کربنات کلسیم استفاده می شود تا به کربنات کلسیم اجازه دهد آزادانه در آب حل شود. برخی از مرجان ها برای ساختن اسکلت خود استفاده می کنند.
به عنوان خنک کننده اولیه در راکتور پیشرفته گاز خنک بریتانیایی برای تولید انرژی هسته ای استفاده می شود.
القای دی اکسید کربن معمولاً برای اتانازی حیوانات آزمایشگاهی مورد استفاده قرار می گیرد. روشهای تجویز CO 2 شامل قرار دادن حیوانات مستقیماً در یک محفظه بسته و از پیش پر شده حاوی CO 2 یا قرار گرفتن در معرض غلظت تدریجی افزایش CO 2 است . دستورالعمل های انجمن پزشکی دامپزشکی آمریکا در سال 2020 برای القای دی اکسید کربن بیان می کند که نرخ جابجایی 30 تا 70 درصد حجم محفظه یا قفس در دقیقه برای اتانازی انسانی جوندگان کوچک بهینه است. [141] : 5، 31 درصد CO 2 برای گونه های مختلف بر اساس درصدهای بهینه شناسایی شده برای به حداقل رساندن ناراحتی متفاوت است. [141] : 22
دی اکسید کربن نیز در چندین تکنیک تمیز کردن و آماده سازی سطح استفاده می شود .
تاریخچه کشف

دی اکسید کربن اولین گازی بود که به عنوان یک ماده مجزا توصیف شد. در حدود سال 1640، [142] شیمیدان فلاندری یان باپتیست ون هلمونت مشاهده کرد که وقتی زغال چوب را در ظرف دربسته می سوزاند ، جرم خاکستر به دست آمده بسیار کمتر از زغال چوب اولیه است. تعبیر او این بود که بقیه زغال چوب به ماده ای نامرئی تبدیل شده است که او آن را “گاز” (از یونانی “آشوب”) یا “روح وحشی” ( spiritus sylvestris ) نامید. [143]
خواص دی اکسید کربن در دهه 1750 توسط پزشک اسکاتلندی جوزف بلک مورد مطالعه قرار گرفت . او دریافت که سنگ آهک ( کربنات کلسیم ) را می توان حرارت داد یا با اسیدها تصفیه کرد تا گازی تولید کند که او آن را “هوای ثابت” نامید. او مشاهده کرد که هوای ثابت چگال تر از هوا است و نه شعله و نه حیات حیوانی را پشتیبانی می کند. بلک همچنین دریافت که وقتی از طریق آب آهک (محلول آبی اشباع هیدروکسید کلسیم ) حباب می شود، کربنات کلسیم را رسوب می دهد. او از این پدیده برای نشان دادن اینکه دی اکسید کربن توسط تنفس حیوانات و تخمیر میکروبی تولید می شود استفاده کرد. در سال 1772، جوزف پریستلی شیمیدان انگلیسی مقاله ای تحت عنوان اشباع آب با هوای ثابت منتشر کرد که در آن فرآیند چکاندن اسید سولفوریک (یا روغن ویتریول همانطور که پریستلی آن را می دانست) روی گچ به منظور تولید دی اکسید کربن و وادار کردن گاز به با هم زدن یک کاسه آب در تماس با گاز حل می شود. [144]
دی اکسید کربن اولین بار در سال 1823 توسط هامفری دیوی و مایکل فارادی (در فشارهای بالا) به مایع تبدیل شد . [145] اولین توصیف از دی اکسید کربن جامد ( یخ خشک ) توسط مخترع فرانسوی آدرین-ژان-پیر تیلوریه ارائه شد که در سال 1835 یک ظرف تحت فشار از دی اکسید کربن مایع را باز کرد و متوجه شد که سرمایش حاصل از تبخیر سریع است. از مایع یک “برف” از CO 2 جامد به بار آورد . [146] [147]
دیاکسید کربن در ترکیب با نیتروژن از زمانهای قبل با نامهای Blackdamp ، stythe یا choke damp شناخته میشد . اکسیداسیون آهسته زغال سنگ و فرآیندهای بیولوژیکی جایگزین اکسیژن شد تا مخلوط خفه کننده ای از نیتروژن و دی اکسید کربن ایجاد شود. [149]
همچنین ببینید
- آزمایش گاز خون شریانی – آزمایش خون گرفته شده از یک سرخرگ که مقدار گازهای محلول خاص را اندازه گیری می کند
- واکنش بوش – کربن عنصری را از CO2 و هیدروژن با استفاده از یک کاتالیزور فلزی تشکیل می دهد
- حذف دی اکسید کربن – حذف دی اکسید کربن اتمسفر از طریق فعالیت های انسانی (از جو)
- فهرست نیروگاه های کم مصرف کربن
- فهرست کشورها بر اساس انتشار دی اکسید کربن
- دریاچه مرومیکتیک – دریاچه ای دائمی طبقه بندی شده با لایه های آبی که با هم مخلوط نمی شوند
- گیلبرت پلاس – فیزیکدان کانادایی (1920-2004) (کار اولیه روی CO 2 و تغییرات آب و هوا)
- واکنش ساباتیر - فرآیند متاناسیون دی اکسید کربن با هیدروژن
- رصدخانه کربن مدار 2 ناسا – ماهواره آب و هوای ناسا
- ماهواره رصد گازهای گلخانه ای – ماهواره رصد زمین
- گاز خاک – خاک – تبادل گازها بین ریشه گیاه و جو


![{\displaystyle K_{\mathrm {h} }={\frac {{\ce {[H2CO3]}}}{{\ce {[CO2_{(aq)}]}}}}=1.70\times 10^{ -3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b01be634ec0c3d83cbf3aa2c71bbd51b9ce0e26)
![{\displaystyle K_{\mathrm {a1} }={\frac {{\ce {[HCO3- ][H+]}}}{{\ce {[H2CO3]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6013fac05dba06751345e4d824c525ed2c43b12)
![{\displaystyle K_{\mathrm {a1} }{\rm {(ظاهری)}}={\frac {{\ce {[HCO3- ][H+]}}}{{\ce {[H2CO3] + [CO2_ {(aq)}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3ae2fa07440c037d6054ce4e7ef95c15c59264e7)